2 月 25 日,国务院应对新冠肺炎疫情联防联控机制科研攻关组印发《关于规范医疗机构开展新型冠状病毒肺炎药物治疗临床研究的通知》,就国家启动公共卫生应急机制期间,有关「老药新用」开展抗新冠肺炎治疗临床研究,提出 4 个方面要求。

各省、自治区、直辖市及计划单列市科技厅(委、局)、卫生健康委、药品监督管理局,新疆生产建设兵团科技局、卫生健康委、药品监督管理局,各有关单位:
为进一步做好新型冠状病毒肺炎(以下简称新冠肺炎)疫情防控工作,促进有潜在抗病毒或对症治疗作用的药品及早进入临床应用,根据《传染病防治法》、《药品管理法》、《医疗机构管理条例》、《涉及人的生物医学研究伦理审查办法》和《医疗卫生机构开展临床研究项目管理办法》,就国家启动公共卫生应急机制期间,有关“老药新用”开展抗新冠肺炎治疗临床研究,提出以下要求:
一、支持符合条件的医院开展相关药品临床研究
相关临床研究原则上应当在县级以上地方卫生行政部门确定的新冠肺炎救治定点医院(包括方舱医院等)进行。所使用的药品应为已上市药品。相关药品应在体外实验中对新冠病毒具有明确的抑制作用,或动物实验结果支持开展新冠肺炎治疗临床研究。在临床研究中给药方法不超过现有药品说明书的用法用量,预期人体内药物浓度可以达到体外实验换算到人体的有效浓度。医疗机构是临床研究的责任主体。临床研究活动应由副高及以上专业职称的执业医师负责,针对轻、中、重症患者分层制定完善的临床研究方案,对可能出现的风险制定预案和管控措施。
二、提高相关药品临床研究的整体效率
各级卫生和科技行政部门要及时收集辖区内医疗机构和科研机构所提出的拟开展临床研究的药品,及时通过省级卫生和科技行政部门上报国务院应对新冠肺炎疫情联防联控机制(以下简称联防联控机制)科研攻关组组长单位科技部的办公厅,科研攻关组下设的药物研发专班要尽快组织专家组研讨并提出初步意见;推荐进入临床研究的,由科研攻关组及时将推荐意见转至科研攻关组副组长单位国家卫生健康委的科教司,由国家卫生健康委科教司统一协调医疗机构承接临床研究任务。开展相关药品临床研究的医院应当按照《医疗机构开展临床研究项目管理办法》的要求进行伦理审查、立项,按要求备案,并在医学研究登记备案信息系统(网址:http://114.255.48.20)上传有关信息。医院要提供条件保障伦理委员会紧急独立开展伦理审查。伦理委员会要提高审查效率,在保障伦理审查质量的前提下,加强指导和支持,简化文档要求。各级卫生和科技行政部门应当加强统筹协调,促进数据整合,提高研究效率。
三、促进相关药品临床研究规范开展
开展相关药品临床研究,应当坚持治疗优先、疫情防控优先,坚决防止因研究影响患者治疗、影响整体疫情防控工作开展。对创新性强以及风险较高的项目,要加强科学性审查和风险评估。开展相关临床研究活动应有适当经费保障,要参考《药物临床试验质量管理规范》开展全过程质量控制和风险管控。医院根据需要可聘请独立于药品供应方、参与临床研究工作的医务人员和患者的数据安全监查委员会,委员会可以在临床研究结束之前定期对研究进展情况进行评判,如发现试验组有明显的毒副作用,或者无明确的治疗效果,立即向医疗机构报告,医疗机构提前终止研究,并及时上报联防联控机制科研攻关组;对疗效明确的则应促进药品尽快推广使用,以尽快使更多患者受益。对未设独立的数据安全监查委员会的,医疗机构要随时关注药物可能的毒副作用,如有明显毒副作用或无明确治疗效果,应立即终止临床研究,切实保障受试者的权益。
四、推动临床研究成果的应用
各级卫生和科技行政部门要及时收集辖区内医疗机构相关药品临床研究工作进展情况,汇总临床研究结果,上报联防联控机制科研攻关组。联防联控机制科研攻关组组织药物研发专班统一汇总相关研究信息,初步审查后,将效果较好的药品推荐至联防联控机制医疗救治组(国家卫生健康委医政医管局),由医疗救治组组织专家研究决定是否扩大使用范围或纳入诊疗方案。疫情防控期间,由科研攻关组建立药品临床研究信息的统一发布机制。
请各级卫生和科技行政部门及时将此通知转至辖区内相关医疗机构和科研机构遵照执行,并将已开展的相关药品的临床研究,按本通知要求履行相关报备程序。经药品监管部门批准的新冠肺炎适应症的药物临床试验,需要依法依规开展,不在本通知范围内。
国务院应对新型冠状病毒感染的肺炎
疫情联防联控机制科研攻关组
(代章)
2020年2月24日
疫情期间,人员不能聚集,工作又不能落下
伦理委员会如何紧急开展伦理审查?
在药政部门支持下
联盟及成员单位早在2019年就一起构建了
《伦理审查云平台》
可在线进行会议审查和快速审查
在线投票表决、电子签名等
期待机构老师联系
(系统免费,仅收取少量维护费)

-/ 功能特色 /-
❑ 项目在线申请
1、伦理委员会依据SOP把文档目录模板嵌入平台。
2、申请人根据平台模板在线提交项目信息及资料。
3、有疑问或者缺失资料,各方均可在线反馈。

▲ 审查列表
❑ 伦理在线审查
1、支持快审、会审、备案等多种伦理审查方式。
2、伦理在线查阅资料,通过电子签名随时随地在线审批。
3、自动生成审查批件。

▲ 不良事件审查
❑ 会议在线管理
1、在线发布会议信息,及时通知参会人员。
2、在线投票并自动生成表决结果。

▲ 审查意见栏
❑ 文档管理
1、自动归档审查过程中产生的审查文档。
2、集中管理每个项目历次审查生成的文档。
3、所有文档访问实施安全有效的权限控制。
❑ 项目统计
提供强大的查询统计功能,可进行年度审查项目数、项目类型、参与科室、伦理会议出勤情况、审查情况等多维度统计,并一键生成报表,准确整合数据,为伦理委员会管理提供全面详细信息。
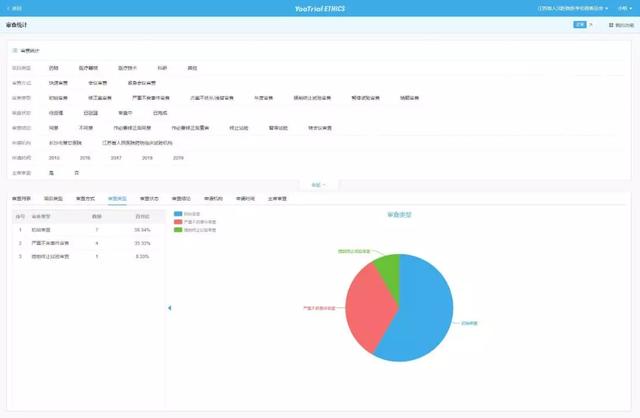
▲ 项目统计
-/ 平台优势 /-
❑ 完善的合规设计
平台依据WHO的 SIDCER认证及美国人体研究组织AAHRPP认证规范,并遵循NMPA GCP、《涉及人的生物医学研究伦理审查办法》、《药物临床试验伦理审查工作指导原则》、《医疗器械临床试验质量管理规范》、《国际多中心药物临床试验指南》等要求,从底层架构出发,保证各业务环节合规性,并在此前提下可进行灵活性配置,提高伦理审查质量。
❑ 全流程信息化管理
平台覆盖伦理审查全业务流程, 支持所有项目类型,覆盖所有审查类别,支持所有审查方式,即可在线安排会审也可在线安排快审,平台根据项目类型及审查方式,自动匹配相应文档,自动生成审查批件及相关文件。
❑ 集中化、自动化文档管理
从审查、项目两个层次对文档进行管理,每次审查过程中提交的审查文档、审查批件/意见实现自动归档。每个项目历次审查文档集中管理,并可实现不同角色之间权限的差异化管理。
❑ 全面消息提醒机制
待办工作主动推送,各类消息及时提醒,在业务各关键节点以系统消息、短信消息等多种方式主动通知到责任人,提高工作效率、简化管理流程。
-/ 研发意义 /-
通过伦理审查云平台(YooTrial ETHICS),能实现提高效率,保证质量,促进合规,助力监管等工作目标,有效推进临床试验各项工作,提高我国伦理审查整体水平。
联盟的宗旨是:牵头组织药物评价领域的重大技术攻关;协助政府开展行业研究;协调和维护药物评价行业主体合法利益、提高市场配置资源的效率和维护市场经济的运行秩序。

联系方式:17375756223(刘老师)
邮 箱:ywpjlm@drugunion.org